Viele Fragen rund um das neue Coronavirus sind noch offen. Doch eines ist schon jetzt klar: Der Erreger trifft uns alle, Chinesen ebenso wie Deutsche, Südafrikaner wie US-Amerikaner. Auch der Kampf gegen die Erkrankung wird zunehmend grenzüberschreitend geführt. Die Universität Bonn ist in zahlreiche internationale Netzwerke eingebunden, die die Infektionswelle bremsen wollen – auf ganz unterschiedlichen Ebenen.
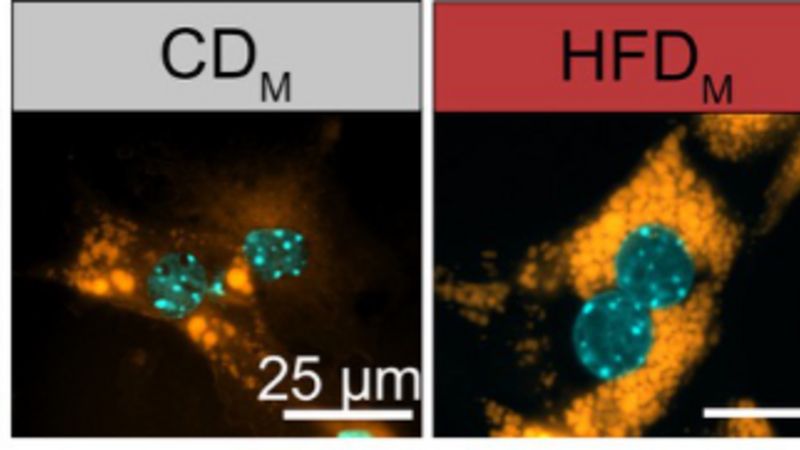
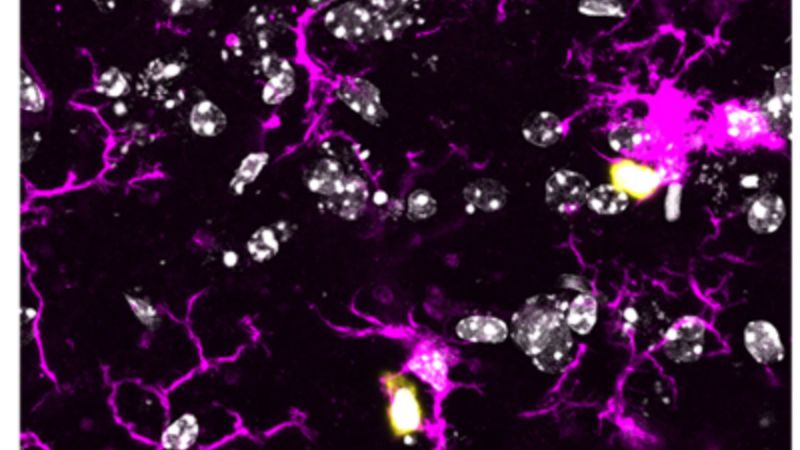
Als mögliches Schlüsselmolekül der Erkrankung gilt der so genannte ACE2-Rezeptor. Das SARS-Coronavirus-2 scheint ihn als Einfallstor zu nutzen, durch das es in die Zelle gelangt. Doch welche Zellen bilden diesen Rezeptor überhaupt? Und wie wird seine Herstellung reguliert?
Mitglieder des so genannten HCA Lung Biology Network sind dieser Frage in den letzten Wochen nachgegangen. Das Akronym HCA steht für „Human Cell Atlas“, und sein Name ist Programm: Die Wissenschaftler der weltumspannenden Kooperation erstellen eine Art Karte sämtlicher Zelltypen des Menschen; sie untersuchen, wo diese Zellen gebildet werden und wie sie zusammenarbeiten. Das Lung Biology Network, dem auch die Universität Bonn angehört, konzentriert sich dabei auf die Lunge. Die Forscher haben ihre Daten zusammengetragen und dabei festgestellt, dass nur relativ wenige der unterschiedlichen Lungenzellen über einen ACE2-Rezeptor verfügen. Noch spannender ist allerdings ein weiterer Befund: Demnach wird die Bildung des Rezeptors wahrscheinlich durch Interferon gefördert.
Interferon ist ein Signalmolekül, das Zellen bilden, sobald sie Anzeichen einer Infektion entdecken. Seine Ausschüttung ist einer der ersten Abwehrmechanismen des menschlichen Körpers. Die Untersuchungsergebnisse deuten nun jedoch darauf hin, dass sich ausgelöst durch das Interferon genau das Molekül vermehrt, das die Viren für den Eintritt in die Zelle benötigen. Damit könnte der Erreger möglicherweise sogar von dem Interferon-Warnsignal profitieren und noch schneller weitere Zellen infizieren. Augenblicklich laufen die letzten Experimente zur Überprüfung dieser Befunde.
Internationale Zusammenarbeit als Grundvoraussetzung
Das HCA Lung Biology Network ist ein gutes Beispiel für internationale Zusammenarbeit in Zeiten von Corona. „Um die Pandemie einzudämmen, müssen wir jetzt möglichst schnell möglichst viel über das Virus lernen“, erklärt Prof. Dr. Joachim Schultze vom LIMES-Institut (das Akronym steht für „Life & Medical Sciences“) der Universität Bonn, der zudem am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und der Universität Bonn die PRECISE Platform for Single Cell Genomics and Epigenomics leitet. „Das geht nur durch die enge Kooperation vieler Wissenschaftler weltweit.“
Ziel der vereinten Forschungsanstrengungen ist es, das Virus wieder aus der menschlichen Bevölkerung zu entfernen. Die beste Möglichkeit dazu ist eine wirksame Impfung. Bis die zur Verfügung steht, wird aber noch einige Zeit vergehen, und solange werden vermutlich viele weitere Menschen erkranken. Daher konzentrieren sich Wissenschaftler rund um den Globus momentan zusätzlich auf die Frage, wie Infizierte vor schweren Krankheitsverläufen geschützt werden können. „Wir müssen dazu besser verstehen, wie das Immunsystem auf den Erreger reagiert und welche Menschen unter welchen Umständen ein besonderes Risiko haben, schwer zu erkranken“, betont Schultze. „Nur so können wir dann möglicherweise Maßnahmen entwickeln, um gravierende Verläufe frühzeitig zu erkennen und zu verhindern.“ Dazu komme es auf die Expertise vieler unterschiedlicher Fachdisziplinen an – von klinischen Spezialisten, Virologen, Epidemiologen, Hygiene-Spezialisten, Immunologen und Genetikern, aber beispielsweise auch Biotechnologen, Bioinformatikern, Daten- und Informationswissenschaftlern.
Was läuft bei Schwerstkranken schief?
Ein Beispiel für eine solche Kooperation über die Grenzen der Disziplinen hinweg ist das Europäische Netzwerk LifeTime (https://lifetime-fetflagship.eu/). Die Initiative bringt mehr als 90 Forschungsinstitute in Europa in dem gemeinsamen Ziel zusammen, modernste Methoden aus Biotechnologie und Künstlicher Intelligenz für wichtige medizinische Fragestellungen zu nutzen und weiterzuentwickeln. Das LifeTime-Konsortium hat eine Task Force COVID-19 ins Leben gerufen. Sie koordiniert die Forschungsanstrengungen der verschiedenen Partner, sorgt für eine Priorisierung der Projekte nach Dringlichkeit und erhofftem Erkenntnisgewinn und stellt sicher, dass nicht dieselbe Fragestellung von verschiedenen Gruppen bearbeitet wird. Vor allem unterstützt sie momentan jedoch Wissenschaftler in Italien und Spanien, die herausbekommen wollen, warum es in diesen Ländern so viele schwere Verläufe gibt.
In der Tat ist frappierend, welch unterschiedliche Gesichter COVID-19 zeigt. Doch warum entwickeln manche Patienten kaum Symptome, während sich bei anderen die Lunge lebensbedrohlich entzündet? Es mehren sich die Anzeichen, dass das Immunsystem selbst für manche dieser schweren Schäden verantwortlich ist. Doch welche Gründe gibt es dafür? Und welche weiteren Prozesse gibt es, die bei Schwerstkranken schief laufen?
Blick in die Gen-Bibliothek
Um diese Fragen zu beantworten, kann man sich zum Beispiel ansehen, welche Gene in den Patienten während der Krankheit abgelesen werden. In Deutschland gibt es eine Reihe DFG-geförderter Kompetenzzentren, die auf diesem Gebiet eine besonders große Expertise haben. Die Universität Bonn koordiniert diese so genannten NGS-Zentren (das Akronym steht für „Next Generation Sequencing“), die sich kürzlich zu einer gemeinsamen COVID-19-Initiative zusammengeschlossen haben. „Wir untersuchen darin unter anderem, welche Gene in COVID-19-Kranken im Laufe der Infektion besonders aktiv sind“, sagt Schultze.
Die Spezialisten gewinnen dazu aus Gewebe – zum Beispiel aus Blutproben – die so genannte RNA. Bildlich gesprochen, funktionieren unsere Chromosomen wie ein riesiges Lexikon mit mehreren zehntausend Artikeln. Jeder dieser Einträge enthält die Bauanleitung für ein Protein. Wenn die Zelle dieses Protein benötigt, lässt sie dazu eine Abschrift des entsprechenden Artikels vornehmen. Und diese Abschrift besteht aus RNA. Wenn man nun die gebildeten RNA-Moleküle zwischen verschiedenen Betroffenen vergleicht, finden sich möglicherweise Auffälligkeiten: So kann es sein, dass bestimmte RNA-Abschriften bei schweren Verläufen besonders oft vorkommen.
Um herauszubekommen, was diese besonders aktiven Gene genau machen, speisen die Forscher jede so gefundene RNA-Sequenz – vereinfacht gesagt: die Buchstabenabfolge der Bauanleitung – in riesige Datenbanken ein. Dadurch lässt sich herausfinden, ob aus anderen Studien schon etwas zur Funktion der Erbanlage bekannt ist. Die Mitglieder der COVID-19-NGS-Initiative wollen ihre Daten dazu auch an Kollegen anderer Forschungseinrichtungen in Deutschland weitergeben, insbesondere an Spezialisten in der Auswertung großer Datenmengen. Am Ende kann dann eventuell die Erkenntnis stehen, dass bei schweren Krankheitsverläufen das Gen für einen bestimmten Entzündungsbotenstoff stark hochreguliert ist – und dass es ein bereits zugelassenes Medikament gibt, das gegen exakt diesen Botenstoff wirkt.
Gibt es verschiedene SARS-CoV-2-Erreger?
„Unsere Hoffnung ist also, auf diesem Wege relativ schnell biologische Prozesse zu erkennen, die mit Medikamenten unterbunden werden könnten“, erklärt Schultze. Noch ist nicht sicher, ob sich diese Hoffnung erfüllen wird. Zumindest werden die Erkenntnisse aber wohl zu einem besseren Verständnis des Infektionsablaufs und der Antwort des Immunsystems beitragen. Sie bilden damit einen weiteren kleinen Mosaikstein, der das Bild des neuen Coronavirus ergänzt.
Zusätzlich sind die Sequenzier-Experten der COVID-19-NGS-Initiative noch an weiteren Fronten aktiv: In insgesamt acht Projekten wollen die Beteiligten drängende Probleme zur Erkrankung bearbeiten - zum Genom des Virus sowie der Frage, ob es verschiedene SARS-CoV-2-Erreger gibt und wie sie sich genetisch verändern; zu Begleitinfektionen mit anderen Viren und Bakterien; zur Rolle des Immunsystems bei leichten und bei schweren Verläufen; zu neuen Medikamenten. Und nicht zuletzt zum Einfluss der genetischen Veranlagung auf das individuelle Infektions-Risiko und den Krankheitsverlauf.
Welche Rolle spielen die Gene?
Auch Humangenetiker interessieren sich für die Frage, inwieweit Menschen die Anfälligkeit für den Erreger quasi in die Wiege gelegt ist. Sie untersuchen dazu die komplette genetische Information von Betroffenen – ihr Genom. In der internationalen „COVID-19 host genetics initiative“ wollen sie so unter anderem verstehen, inwieweit beim Menschen vorkommende genetische Varianten die Wahrscheinlichkeit erhöhen, schwere Komplikationen zu entwickeln. An der Universität Bonn sind Prof. Dr. Markus Nöthen und sein Team vom Institut für Humangenetik an diesen Arbeiten beteiligt. Auch die Ergebnisse der oben geschilderten RNA-Untersuchungen beobachten sie dabei mit großem Interesse. Schließlich ist es nicht unwahrscheinlich, dass die auffällige Aktivität der dort identifizierten Gene durch bestimmte Mutationen hervorgerufen wird. „Diese Möglichkeit wollen wir durch die Sequenzierung ganzer Genome von Patienten untersuchen“, erklärt Nöthen.
Momentan geht die Zahl der Neuinfektionen vielerorts zurück. Länder wie Österreich oder Dänemark haben bereits konkrete Pläne vorgestellt, die augenblicklichen Einschränkungen des öffentlichen Lebens zu lockern. Auch Deutschland wird wohl in absehbarer Zeit damit beginnen, die Maßnahmen Schritt für Schritt zurückzufahren. Dabei wird es in den nächsten Monaten wichtig sein, ein Wiederaufflackern der Infektion möglichst schnell zu erkennen und dann wirksam zu unterbinden. Eine Rolle kann dabei das Monitoring von Kläranlagen spielen. „Wir beabsichtigen momentan zusammen mit Kollegen aus Holland die Möglichkeit zu untersuchen, aus der Abwasser-Belastung mit Coronaviren Rückschlüsse auf die Häufigkeit von Infektionen in der Bevölkerung zu gewinnen“, erklärt Prof. Dr. Martin Exner vom Institut für Hygiene und öffentliche Gesundheit der Universität Bonn.
Kläranlagen als Viren-Frühwarnsystem
Er kooperiert dazu unter anderem eng mit der Arbeitsgruppe um Prof. Dr. Hendrik Streeck vom Institut für Virologie. Das Team führt gerade in Heinsberg – einem frühen Hot-Spot der Coronavirus-Epidemie in Deutschland – umfassende Analysen zur Ausbreitung der Infektion durch. Diese haben bereits gezeigt, dass zumindest manche Patienten Viren mit dem Stuhl ausscheiden, von denen aber vermutlich keine Infektionsgefahr ausgeht. Sobald die detaillierten Ergebnisse vorliegen, wird sich auch herausstellen, inwiefern Abwasser-Auswertungen Aussagen über die Zahl der momentan Erkrankten erlauben. „Wir werden wohl noch für Monate oder Jahre mit dem Erreger leben müssen“, betont Exner. „Daher sind solche Frühwarnsysteme natürlich sehr wichtig.“ Seine wissenschaftlichen Partner in den Niederlanden haben bereits mit der Erprobung solcher Abwasser-Tests begonnen.
Auch bei der Entwicklung von Desinfektions-Protokollen ist die internationale Vernetzung essentiell, zumal Viren mit der Zeit auch Resistenzen gegen manche Mittel entwickeln können. Dazu kommt, dass noch nicht klar ist, welche Übertragungswege besonders wichtig sind: tatsächlich nur die mittelgroßen Feuchtigkeits-Tröpfchen, die beim Husten oder Sprechen freigesetzt werden? Oder auch feinere Aerosole, die lange Zeit in der Luft verbleiben, bevor sie zu Boden sinken? Und was passiert dort – auf Böden, Tischplatten und anderen Flächen? Wie lange bleibt es dort infektiös? Die Antwort auf diese Fragen fließt in die Maßnahmen-Empfehlungen ein, die die Ausbreitung des Virus verhindern sollen. Rund um den Globus stimmen sich die wichtigsten Hygiene-Institute regelmäßig über den aktuellen Kenntnisstand zu COVID-19 und die daraus zu ziehenden Konsequenzen ab. „Das betrifft insbesondere Vorschriften bei Untersuchungen und Operationen in Kliniken oder Arztpraxen“, erklärt Exner, der auch Präsident der Deutschen Gesellschaft für Krankenhaushygiene (DGKH) ist.
Das Bild, das wir von der Pandemie haben, wird von Tag zu Tag vollständiger, und der wissenschaftliche Austausch über nationale Grenzen hinweg spielt dabei eine wesentliche Rolle. „In Zeiten wie diesen tut es gut zu sehen, wie hervorragend die unterschiedlichsten Arbeitsgruppen kooperieren, auch wenn sie im Normalfall Konkurrenten sein mögen“, betont Prof. Dr. Joachim Schultze. Die wissenschaftliche Antwort auf die globale Bedrohung könne von dieser Zusammenarbeit nur profitieren. „Das ist, wenn man so möchte, eine der wenigen positiven Konsequenzen, die diese weltumspannende Krise hat.“
Kontakt:
Prof. Joachim Schultze
LIMES-Institut
Genomik und Immunregulation
Tel. 02 28 / 73 - 6 27 87
office.immunogenomics@uni-bonn.de